常見充電機充電鋰電池材料的開路電壓充放電曲線
2018-6-18 14:23:15??????點擊:
各種電極材料的平衡電勢,即開路電壓曲線是電池電壓特性的基礎,了解材料的開路電壓曲線能夠更好理解電池的電壓特性,本文主要介紹充電機充電鋰電池常見材料的開路電壓曲線,收集了部分文獻報道的各材料實驗獲取并擬和得到的開路電壓曲線。歡迎大家指正錯誤,并補充內容。
1、電池的電壓
電池的理論標準電壓E0 (電池)由正極的標準電極電勢E0 (正極)和負極的標準電極電勢E0 (負極)之差來確定,如公式(1)所示:
E0 (電池) = E0(正極) - E0 (負極)
在電池體系中,標準鋰電極普遍作為參考電極,標準電極電勢確定為E0 (Li|Li+)=0,正、負極材料的標準電極電勢一般都是反應物和產物與參比鋰電極之間反應而產生的電勢。
開路電壓是指電池在非工作狀態下即電路中無電流流過時,電池正負極之間的電勢差。對于電極反應:
M2+ + 2e- = M
考慮反應物組分的非標準狀態以及活性組分的活度(或濃度)隨時間的變化,采用能斯特方程修正電池實際開路電壓:
E= E0-RTln(aM/aM2+)
其中,R是氣體常數,T是反應溫度,a是組分活度或濃度。
電池的開路電壓,會依電池正、負極與電解液的材料而異,一般情況下,開路電壓大小與電源電動勢相等,而在閉合電路情況下,電源電動勢=內電壓+外電壓。通過對電池的開路電壓的檢測,可以初步判斷電池的荷電狀態。
工作電壓又稱端電壓,是指電池在工作狀態下即電路中有電流流過時電池正負極之間的電勢差。在電池放電工作狀態下,當電流流過電池內部時,需克服電池的內阻所造成阻力,會造成歐姆壓降和電極極化,故工作電壓總是低于開路電壓,充電時則與之相反,端電壓總是高于開路電壓。
所謂極化,是指電流通過電極時,電極電位偏離其平衡電位的現象。在電極單位面積上通過的電流越大,偏離平衡電極電位越嚴重。通電后電極實際電勢與平衡電勢的差叫作過電勢,電極產生極化的原因,是由于電極反應過程中某一步驟速度緩慢所引起的,實質上是因為電極反應速度、電子傳遞速度與離子擴散速度三者不相適應造成的。因此,電極極化主要包括歐姆極化、電化學極化和濃差極化。
歐姆極化主要由電極材料、電解液、隔膜電阻及集流體、極耳的連接等各部分零件的電阻造成。電化學極化是電解液中電化學反應的速度無法達到電子的移動速度造成的。濃差極化,是鋰離子嵌入脫出正負極材料并在材料中移動的速度小于鋰離子向電極集結的速度造成的。
因此,各種電極材料的平衡電勢,即開路電壓曲線是電池電壓特性的基礎,了解材料的開路電壓曲線能夠更好理解電池的電壓特性,本文主要介紹充電機充電鋰電池常見材料的開路電壓曲線,收集了部分文獻報道的各材料實驗獲取并擬和得到的開路電壓曲線。
2、開路電壓測試方法
電極材料的平衡電勢測試過程為:電極材料制備成極片,與金屬鋰組裝成紐扣半電池,測得紐扣半電池在不同的SOC狀態下的開路電壓,并采用多項式或高斯擬合等確定開路電壓曲線的數學表達式。開路電壓測試方法主要包括:
(1)恒電流間歇滴定技術(galvanostatic intermittent titration technique,GITT), 基本原理是在某一特定環境下對測量體系施加一恒定電流并持續一段時間后切斷該電流,觀察施加電流段體系電位隨時間的變化以及弛豫后達到平衡的電壓(即開路電壓)。GITT測試舉例如下:(i)在C/50下充電直到電壓達到上限電壓,如4.2 V;(ii)靜置2小時;(iii)1C放電6min,記錄放電容量;(iv)靜置15min,記錄電壓;(v)重復步驟(iii)和(iv)共9次;(vi)在C/50下放電直到電壓達到下限電壓,如3.0V;(vii)將步驟(iii)和(iv)記錄的容量-電壓曲線,歸一化處理,做成SOC-電壓曲線,擬合得到開路電壓曲線的數學表達式。
(2)小電流充放電曲線,以特別低的倍率(如0.01C)電流恒流充放電,設置電壓上下限范圍,得到電池小電流充放電曲線,將電量一致的點作為曲線起點,對充放電曲線中的電壓取平均值,將曲線的橫坐標按照理論容量進行歸一化處理,然后利用曲線擬合得到開路電壓曲線。
3、常見鋰電材料開路電壓曲線
(1)鈷酸鋰LiCoO2
電極反應方程式:
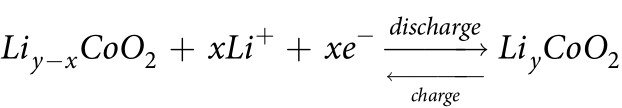
開路電壓曲線:

參考文獻:Mao Z, Farkhondeh M, Pritzker M, et al. Dynamics of a Blended Lithium-Ion Battery Electrode During Galvanostatic Intermittent Titration Technique[J]. Electrochim Acta, 2016, 222: 1741-1750.
(2)鎳酸鋰LiNiO2
電極反應方程式:
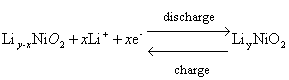
開路電壓曲線:
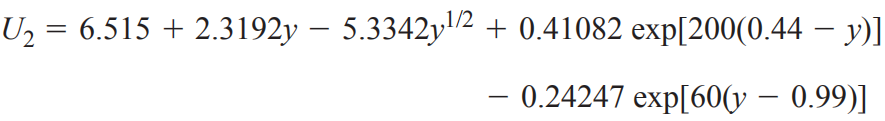
參考文獻:G. Botte, B. A. Johnson, and R. E. White, Influence of Some Design Variables on the Thermal Behavior of a Lithium-Ion Cell, J. Electrochem. Soc., vol. 146, p. 914, 1999.
(3)尖晶石型錳酸鋰LiMn2O4
電極反應方程式:
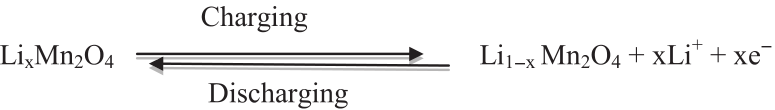
開路電壓曲線:
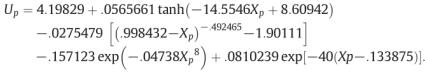
參考文獻:Dubey A M, Ram R, Yadav A K. Ion Cell Performance Using Single Particle Representation of Battery Electrode[J].
(4)磷酸鐵鋰LiFePO4
電極反應方程式:
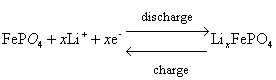
脫嵌鋰過程中具體的相變如圖所示。

開路電壓曲線:
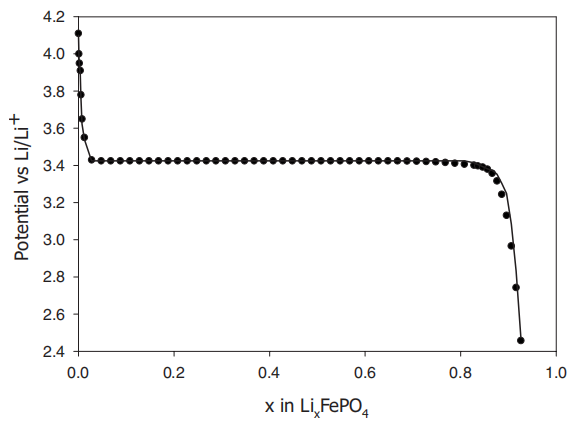
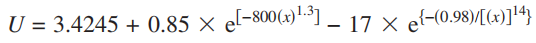
參考文獻:S. Kasavajjula, C. Wang, and P. E. Arce, "Discharge Model for LiFePO4 Accounting for the Solid Solution Range", J. Electrochemical Soc., vol. 155, p. A866, 2008
(5)鎳鈷錳酸鋰NMC
電極反應方程式:
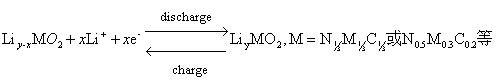
開路電壓曲線:

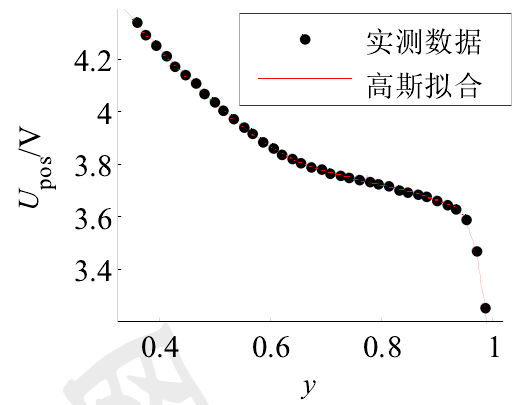
(6)石墨C
電極反應方程式:
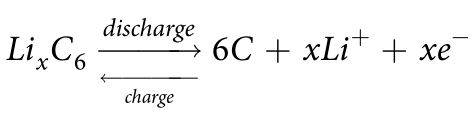
開路電壓曲線:

參考文獻:Jiang F, Peng P. Elucidating the Performance Limitations of Lithium-Ion Batteries due to Species and Charge Transport through Five Characteristic Parameters[J]. Sci Rep-Uk, 2016, 6(32639): 32639.
(7)硅
電極反應方程式:
具體嵌鋰和脫鋰過程:
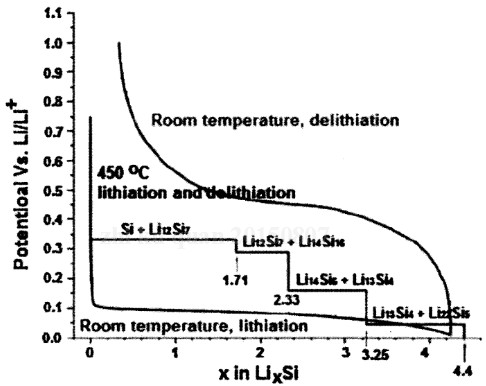
開路電壓曲線:
其中,Z為SOC。
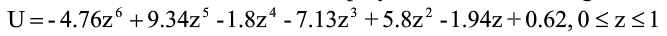
參考文獻:V. A. Sethuraman, V. Srinivasan, and J. Newman, Analysis of Electrochemical Lithiation and Delithiation Kinetics in Silicon, J. Electrochem. Soc., vol. 160, p. A394, 2013
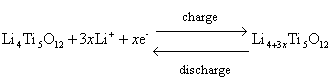
(8)鈦酸鋰Li4Ti5O12
電極反應方程式:
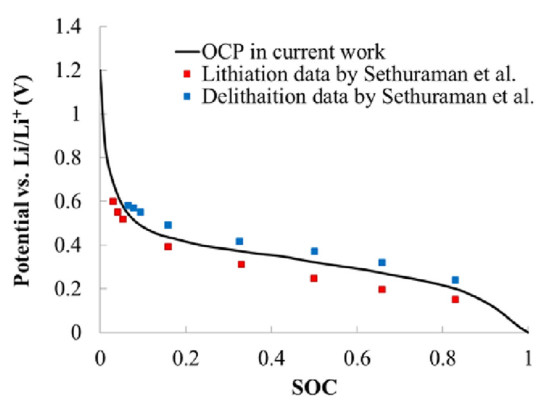
開路電壓曲線:
參考文獻:P. Albertus, J. Couts, and V. Srinivasan, "II. A combined model for determining capacity usage and plug-in hybrid electric vehicles", J. Power Sources, vol. 183, p. 771, 2008
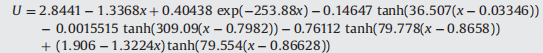
在電化學模擬中,其實就是輸入這些材料的開路電壓曲線,根據鋰離子濃度分布、電極反應速度、電子傳遞速度與離子擴散速度等條件獲取過電勢,通過開路電壓曲線和過電勢計算電池實際充放電曲線。
1、電池的電壓
電池的理論標準電壓E0 (電池)由正極的標準電極電勢E0 (正極)和負極的標準電極電勢E0 (負極)之差來確定,如公式(1)所示:
E0 (電池) = E0(正極) - E0 (負極)
在電池體系中,標準鋰電極普遍作為參考電極,標準電極電勢確定為E0 (Li|Li+)=0,正、負極材料的標準電極電勢一般都是反應物和產物與參比鋰電極之間反應而產生的電勢。
開路電壓是指電池在非工作狀態下即電路中無電流流過時,電池正負極之間的電勢差。對于電極反應:
M2+ + 2e- = M
考慮反應物組分的非標準狀態以及活性組分的活度(或濃度)隨時間的變化,采用能斯特方程修正電池實際開路電壓:
E= E0-RTln(aM/aM2+)
其中,R是氣體常數,T是反應溫度,a是組分活度或濃度。
電池的開路電壓,會依電池正、負極與電解液的材料而異,一般情況下,開路電壓大小與電源電動勢相等,而在閉合電路情況下,電源電動勢=內電壓+外電壓。通過對電池的開路電壓的檢測,可以初步判斷電池的荷電狀態。
工作電壓又稱端電壓,是指電池在工作狀態下即電路中有電流流過時電池正負極之間的電勢差。在電池放電工作狀態下,當電流流過電池內部時,需克服電池的內阻所造成阻力,會造成歐姆壓降和電極極化,故工作電壓總是低于開路電壓,充電時則與之相反,端電壓總是高于開路電壓。
所謂極化,是指電流通過電極時,電極電位偏離其平衡電位的現象。在電極單位面積上通過的電流越大,偏離平衡電極電位越嚴重。通電后電極實際電勢與平衡電勢的差叫作過電勢,電極產生極化的原因,是由于電極反應過程中某一步驟速度緩慢所引起的,實質上是因為電極反應速度、電子傳遞速度與離子擴散速度三者不相適應造成的。因此,電極極化主要包括歐姆極化、電化學極化和濃差極化。
歐姆極化主要由電極材料、電解液、隔膜電阻及集流體、極耳的連接等各部分零件的電阻造成。電化學極化是電解液中電化學反應的速度無法達到電子的移動速度造成的。濃差極化,是鋰離子嵌入脫出正負極材料并在材料中移動的速度小于鋰離子向電極集結的速度造成的。
因此,各種電極材料的平衡電勢,即開路電壓曲線是電池電壓特性的基礎,了解材料的開路電壓曲線能夠更好理解電池的電壓特性,本文主要介紹充電機充電鋰電池常見材料的開路電壓曲線,收集了部分文獻報道的各材料實驗獲取并擬和得到的開路電壓曲線。
2、開路電壓測試方法
電極材料的平衡電勢測試過程為:電極材料制備成極片,與金屬鋰組裝成紐扣半電池,測得紐扣半電池在不同的SOC狀態下的開路電壓,并采用多項式或高斯擬合等確定開路電壓曲線的數學表達式。開路電壓測試方法主要包括:
(1)恒電流間歇滴定技術(galvanostatic intermittent titration technique,GITT), 基本原理是在某一特定環境下對測量體系施加一恒定電流并持續一段時間后切斷該電流,觀察施加電流段體系電位隨時間的變化以及弛豫后達到平衡的電壓(即開路電壓)。GITT測試舉例如下:(i)在C/50下充電直到電壓達到上限電壓,如4.2 V;(ii)靜置2小時;(iii)1C放電6min,記錄放電容量;(iv)靜置15min,記錄電壓;(v)重復步驟(iii)和(iv)共9次;(vi)在C/50下放電直到電壓達到下限電壓,如3.0V;(vii)將步驟(iii)和(iv)記錄的容量-電壓曲線,歸一化處理,做成SOC-電壓曲線,擬合得到開路電壓曲線的數學表達式。
(2)小電流充放電曲線,以特別低的倍率(如0.01C)電流恒流充放電,設置電壓上下限范圍,得到電池小電流充放電曲線,將電量一致的點作為曲線起點,對充放電曲線中的電壓取平均值,將曲線的橫坐標按照理論容量進行歸一化處理,然后利用曲線擬合得到開路電壓曲線。
3、常見鋰電材料開路電壓曲線
(1)鈷酸鋰LiCoO2
電極反應方程式:
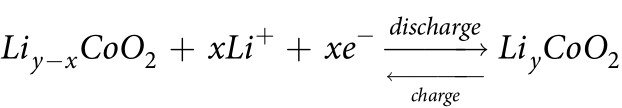
開路電壓曲線:

參考文獻:Mao Z, Farkhondeh M, Pritzker M, et al. Dynamics of a Blended Lithium-Ion Battery Electrode During Galvanostatic Intermittent Titration Technique[J]. Electrochim Acta, 2016, 222: 1741-1750.
(2)鎳酸鋰LiNiO2
電極反應方程式:
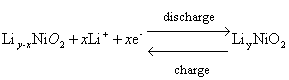
開路電壓曲線:
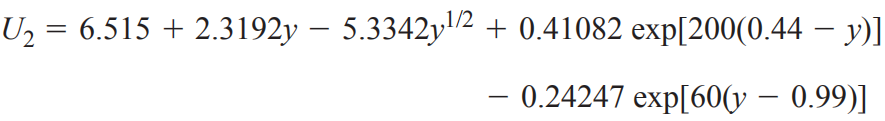
參考文獻:G. Botte, B. A. Johnson, and R. E. White, Influence of Some Design Variables on the Thermal Behavior of a Lithium-Ion Cell, J. Electrochem. Soc., vol. 146, p. 914, 1999.
(3)尖晶石型錳酸鋰LiMn2O4
電極反應方程式:

開路電壓曲線:
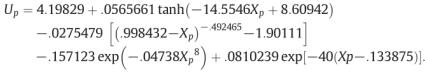
參考文獻:Dubey A M, Ram R, Yadav A K. Ion Cell Performance Using Single Particle Representation of Battery Electrode[J].
(4)磷酸鐵鋰LiFePO4
電極反應方程式:
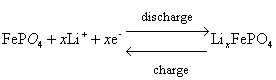
脫嵌鋰過程中具體的相變如圖所示。

開路電壓曲線:

參考文獻:S. Kasavajjula, C. Wang, and P. E. Arce, "Discharge Model for LiFePO4 Accounting for the Solid Solution Range", J. Electrochemical Soc., vol. 155, p. A866, 2008
(5)鎳鈷錳酸鋰NMC
電極反應方程式:
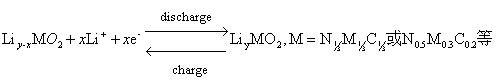
開路電壓曲線:


(6)石墨C
電極反應方程式:
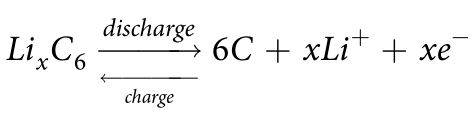
開路電壓曲線:

參考文獻:Jiang F, Peng P. Elucidating the Performance Limitations of Lithium-Ion Batteries due to Species and Charge Transport through Five Characteristic Parameters[J]. Sci Rep-Uk, 2016, 6(32639): 32639.
(7)硅
電極反應方程式:
具體嵌鋰和脫鋰過程:

開路電壓曲線:
其中,Z為SOC。
參考文獻:V. A. Sethuraman, V. Srinivasan, and J. Newman, Analysis of Electrochemical Lithiation and Delithiation Kinetics in Silicon, J. Electrochem. Soc., vol. 160, p. A394, 2013
(8)鈦酸鋰Li4Ti5O12
電極反應方程式:

開路電壓曲線:

參考文獻:P. Albertus, J. Couts, and V. Srinivasan, "II. A combined model for determining capacity usage and plug-in hybrid electric vehicles", J. Power Sources, vol. 183, p. 771, 2008
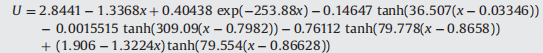
在電化學模擬中,其實就是輸入這些材料的開路電壓曲線,根據鋰離子濃度分布、電極反應速度、電子傳遞速度與離子擴散速度等條件獲取過電勢,通過開路電壓曲線和過電勢計算電池實際充放電曲線。
- 上一篇:基于充電機充電純鉛蓄電池的風機發電機組備用電源系統 2018/6/21
- 下一篇:晶界處原位轉換“補丁”提高充電機充電鈣鈦礦太陽能蓄電池穩定性 2018/6/18
